中国や欧州連合では、化粧品と医薬品の定義が明確に区別されています。一方、米国では、化粧品と医薬品が重なり合うことがあります。つまり、同じ製品が化粧品である同時に、一般用医薬品(Over-the-Counter、OTC)でもあります。
では、米国においてどのような化粧品がOTC製品とみなされるのでしょうか?その規制要件とは?また、米国へ製品を輸出する企業はどのようなコンプライアンスに注意すべきでしょうか?REACH24Hが関連内容をまとめましたので、一緒に見ていきましょう。
OTC製品とは
OTC製品を説明する前に、まず米国における化粧品と医薬品の定義を確認してみましょう。
化粧品
連邦食品・医薬品・化粧品法(FD&C法)によると、化粧品とは「人の体に塗る、馴染ませる、スプレーする等により、体をきれいに清潔し、美しくし、魅力を高め、または外見を変えるためのもの(石鹸以外)」と定義されます。
米国の化粧品は、メイクアップ(フェイス/アイ、成人/子供向け)やヘアカラー・パーマ製品、口腔ケア製品、制汗剤、ベビーケア製品、パーソナルクレンジング製品、タンニング製品など17のカテゴリーに分類されます。
医薬品
医薬品とは、食品以外のもので、病気を診断・治療・緩和・予防すること、または人や動物の身体構造や機能に影響を与えることを目的とする製品を指します。
OTC製品
OTC製品は医薬品の一種であり、米国食品医薬品局(FDA)の監督・管理を受けています。OTC製品は、FDAが定める製品の品質・有効性・安全性の基準を満たさなければなりません。
米国では、OTC製品にはさまざまな種類があり、一般的な解熱鎮痛剤や風邪薬、制汗剤などもOTC製品に分類されます。
現在、米国では一部のリスクが少々高く、特定の効能や成分を含む化粧品をOTC製品として管理しています。このような管理方法は、化粧品が2つの異なる用途を持ち、それぞれが化粧品およびOTC製品の効能を満たしている場合に適用されます。
例えば、フケシャンプーは洗髪機能においては化粧品に該当しますが、フケ防止の効果を持つためOTC医薬品にも該当します。そのため、フケ防止シャンプーは米国で化粧品とOTC製品の両方に分類されます。そのような製品には、フッ化物を含む歯磨き粉や制汗効果のあるデオドラント、日焼け止め製品などもあります。
製品がOTC規制の対象かどうかをどう判断するか?
では、ある製品が米国でOTC規制の対象となるかどうかをどのように判断すればよいのでしょうか?一般的に、以下の2つの方法があります。
製品の宣伝
製品ラベルや広告、ウェブサイト、その他の宣伝資料における記載内容などです。化粧品が医薬品としての効能にかかわる場合、その製品はOTC医薬品として監督・管理される可能性があります。
例えば、マウスウォッシュ製品にある細菌の繁殖を抑制することで口臭を和らげるという記載は、医薬品の効能表示とみなされます。
製品の成分
製品に含まれる成分の中には、医薬品として認識されているものがあり、その成分が業界で一般的に治療目的で使用されている場合です。例えば、歯磨き粉にあるフッ化物が挙げられます。
OTCモノグラフ
より実践的な方法としては、米国のOTCモノグラフを参照することです。モノグラフは、特定の薬効を有する活性成分の基準とみなすことができます。
モノグラフに記載されている成分は、効能が製品のと一致していれば、その製品はOTC製品として規制される可能性が高いです。
OTCモノグラフにおける化粧品関連の活性成分の効能には、主に以下が含まれます。例えば、ニキビ・ざ瘡治療成分、日焼け止め成分、虫歯予防成分、歯の知覚過敏抑制成分、特定の皮膚保護剤(収れん剤や皮膚の乾燥やひび割れの治療、オムツかぶれ治療を含む)、フケ防止成分、抗菌成分、制汗成分などです。
米国のOTC製品に対する規制要件
OTCモノグラフの合致
OTCモノグラフに記載されている活性成分は、「一般的に安全かつ有効である(Generally Recognized as Safe and Effective, GRASE)」と認定されています。つまり、FDAがその製品の安全性と有効性を確認しているということです。
モノグラフには、活性成分の使用基準や制限、ラベル、その他の一般要件が記載されています。製品がモノグラフの要件を満たしている場合、FDA承認を受けなくて、上市前に製品リストを簡単に行ってすみます。
新薬承認申請
OTCモノグラフに合致しない場合、製品の適合ルートは新薬承認申請(New Drug Application, NDA)となります。この申請プロセスでは、完全な医薬品申請資料を提出する必要があるため、、化粧品企業がこの選択肢を検討することはないでしょう。。
OTCモノグラフに記載された活性成分を含む製品は、上市前にFDA承認を受けませんが、その他の適合要件を満たす必要があります。
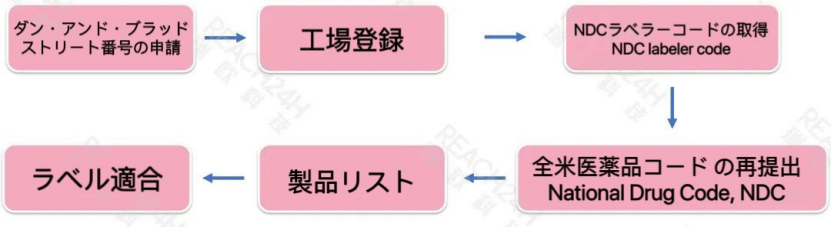
OTCモノグラフ医薬品の登録プロセス
OTC関連の工場は、工場登録を行う必要があり、またFDAの関連GMPを遵守しなければなりません。市場で販売されるOTC製品は、全米医薬品コード (NDC) (医薬品及びパッケージをを識別するために使用される11桁のコード)を取得する必要があります。OTC製品は、市場販売開始後5日以内に製品リスト登録を完了し、OTC製品に関するラベル要件を遵守する必要があります。
注意すべきなのは、米国「2022 年化粧品規制現代化法(MoCRA)」の施行後、化粧品も工場登録および製品リスト登録を行う必要があります。ただし、その工場登録および製品リスト登録は、OTCのとは異なるプラットフォームで行われます。
さらに、製品が化粧品とOTCの両方に該当する場合、化粧品プラットフォームでの製品リスト登録は不要となります。
OTC製品の準拠に関するすすめ
適切な宣伝内容
製品の想定される使用目的は、製品カテゴリーを区分する基準です。FDAは主に製品の宣伝内容や消費者の認識、製品配合に基づき、想定される用途を確認し、それに製品のカテゴリーを判断します。製品の宣伝内容は消費者の認識を大きく左右するため、FDA審査の重要なポイントとなります。
企業は、製品の宣伝内容がそれに対応する製品カテゴリーに適合していることを、確認しなければなりません。

例:エッセンシャルオイル製品
化粧品:肌の保湿や香りの付与、魅力の向上など化粧品の効果だけ宣伝する場合、その製品は化粧品の定義に該当し、化粧品の規制を受けます。
OTC:もし、製品の「アロマセラピー」というような効果、例えば睡眠の改善や筋肉痛の緩和などを宣伝する場合、その製品は医薬品の定義に該当し、活性成分に応じてOTCまたは処方薬として規制されます。
また、医薬品としての効果を持つ製品の活性成分がOTCモノグラフに記載される場合は、その基準を満たす必要があります。ただし、OTCモノグラフに記載されていない、またはFDAの承認を受けていない場合は、新薬承認申請が必要となります。
ラベル要件の遵守
OTC製品には特別なラベル要件があります。例えば、活性成分と 非活性成分の別途記載が挙げられ、活性成分に関する具体的な含有量と使用目的の記載などが必要です。OTCモノグラフに記載されている活性成分や製品タイプについて、モノグラフには具体的なラベル要件が定められています。
規制体系の違いにより、中国で化粧品として規制されている製品が、米国ではOTC製品や医薬品として扱われる可能性があります。REACH24H JAPAN株式会社は、事前に現地の規制要件を理解し、製品分類を明確にすることで、上市前のコンプライアンスをスムーズに進められるようおすすめします。

