API 登録とバックグラウンドの概要
2016年の医薬品審査・承認制度改革以降、中国の原薬、医薬品賦形剤、医薬品包装材料は、関連する審査・承認の段階に徐々に入っています。
中華人民共和国薬品管理法、中華人民共和国薬品管理法施行規則、医薬品登録管理弁法、原薬、医薬品賦形剤、医薬品包装材料の審査・承認の調整に関する総局の公告(2017年第146号)、国家食品薬品監督管理局の医薬品関連製品の審査・承認・監督に関する事項のさらなる改善に関する公告(2019年第56号)およびその他の法律および規制、原薬、 医薬品賦形剤および包装材料の登録者は、国家薬品監督管理局の医薬品評価センター(CDE)のプラットフォームで関連資料を登録して提出できます。
◆API、医薬品賦形剤、医薬品包装材料が登録番号を取得した後、CDEプラットフォームは、対応するAPI、医薬品賦形剤、医薬品包装材料の登録番号、製品名、企業名、製造住所などの基本情報を公表します。
API 登録の要件
API登録者は、法律に従って、国家薬品監督管理局の医薬品評価センター(CDE)のプラットフォームに登録する必要があります。
※国内の原薬メーカーは、自社製品をAPI登録者として自己登録しています。 原薬の海外生産は、中国の代理店に委託して登録することができます。
登録対象:
経路(1):国内で販売されているAPIは独立した審査を申請することができ、審査に合格すると登録番号が自動的に「A」に変わります。
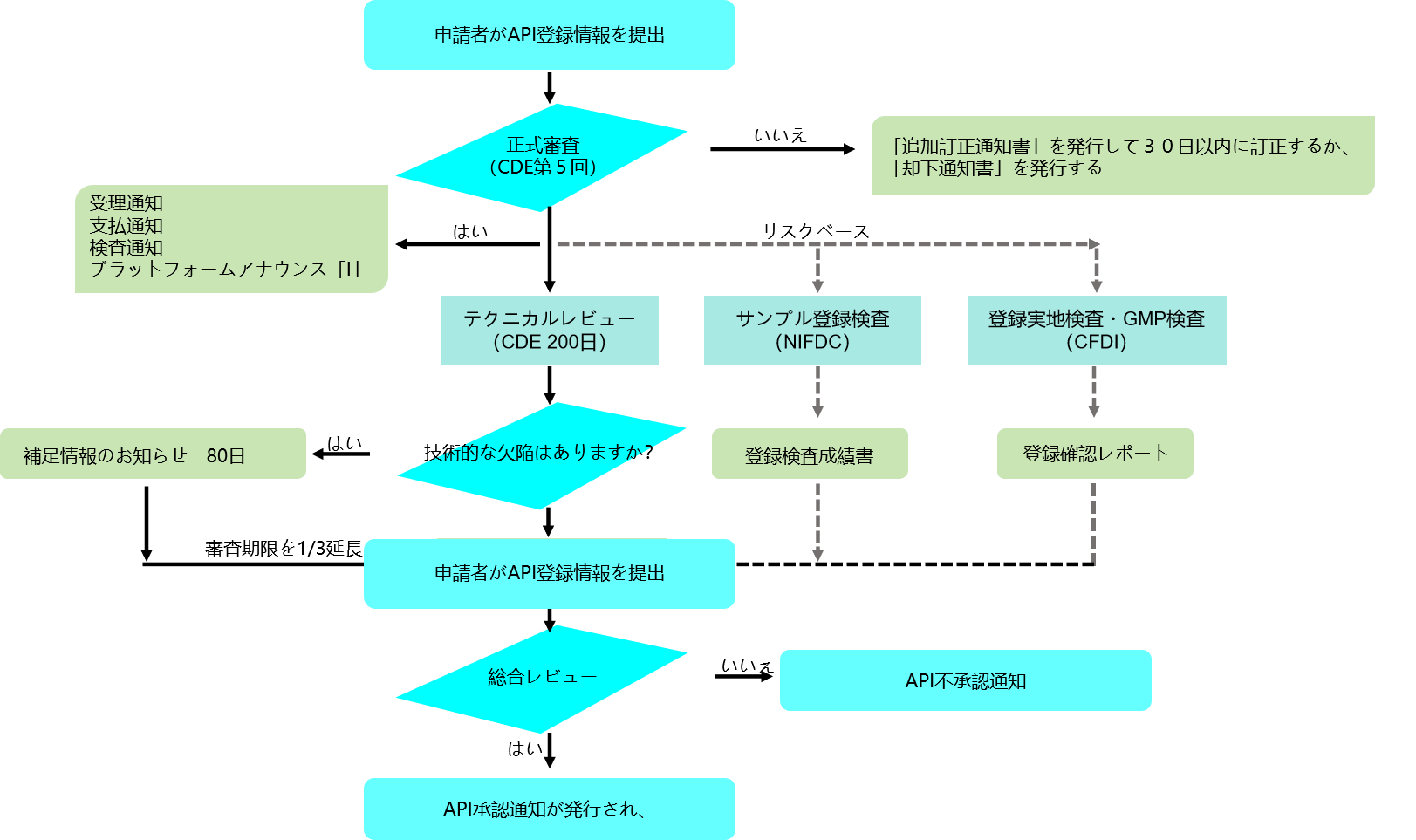
経路(2):APIは、プラットフォーム上での登録完了後、正式な審査を経て「I」ステータスの登録番号を取得し、準備に紐づいて、登録番号のステータスが「I」から「A」に変わると、技術審査に合格する。
API の登録とプロセス
登録の種類
中国国内外で開発・生産された原薬。
登録情報の要件
APIは、化学医薬品の登録分類および申請資料の要件の発行に関する国家食品医薬品局の通知(2020年第44号)の要件を満たす必要があります。
登録プロセス
サービス内容
· API申請資料の概要を記入する。
· 登録データのギャップ分析、品種情報に基づく事前レビュー、および準備レビューの要件に基づく顧客への修正提案を実施します。
· 登録資料のレビュー、翻訳、編集、提出。
· API登録の正式なレビューの全プロセスをフォローアップし、補足質問と補足回答資料を提出します。
· API登録データの更新(メジャーな変更、中程度の変更、マイナーな変更、基本情報の変更を含む)
· 登録原薬の年次報告書情報の提出

