規制の概要
ドラッグマスターファイル(DMF)は、製品の一般情報、製造プロセス、不純物研究、安定性、およびデータとデータのその他の側面を含む、製品の化学、生産、および品質管理情報に関する完全な文書セットです。 DMFは、1つ以上の臨床研究申請、革新的医薬品申請、簡易新薬申請、輸出申請、および上記申請に対する変更または補足として用いることができ、また、別のDMFの参照文書としても用いることができる。 米国食品・医薬品・化粧品法、連邦規則集第21編、およびDMF Guidance for Industryによると、DMFは必須ではありません。 製品に関する技術情報を非公式の第三者に開示したくない賦形剤および包装容器の製造業者は、登録番号と申請のために、DMFファイルの形式で技術情報を米国食品医薬品局(FDA)に提出することができます。 DMFがアーカイブされた後、作成者は、調剤申請資料に含めるべきAPI、賦形剤、包装容器の技術情報をDMF出願番号に直接置き換えることができるため、一方では準備申請の内容が簡素化され、他方では、原薬メーカー、賦形剤、包装容器メーカーの情報機密性のニーズが解決されます。
DMF 状況には、以下の 2 つのタイプがあります。
"A"=Active:DMFが登録番号(出願番号または出願番号)を取得し、正常に維持され、利用可能であることを示す、アクティブ状態。
"I" = Inactive: DMFが保有者またはFDAによってクローズされ、利用できないことを示す非アクティブ状態。
企業の義務と対処戦略
元請け業者および補助請負業者の製造業者は、保有者としてDMF登録のための文書の形で米国食品医薬品局(FDA)に技術情報を提出し、当局は、海外の製造業者が米国の代理店を通じてDMFを登録し、FDAと連絡を取り合い、関連する登録事項を処理することを推奨しています。
登録の目的: DMFの登録後、管理審査に合格したオリジナルパッケージと補助パッケージは「A」ステータスの登録番号を取得し、登録番号のステータスは、プレパレーションに関連付けられているときに変更されません。
登録と手続き
登録の種類
FDAはDMFを次のように分類しています。
タイプI:製造拠点、施設および設備、標準作業手順および人員*。
タイプII:API、中間体およびそれらに使用される原材料、または医薬品製剤。
タイプIII:包装材料/容器;
タイプIV:賦形剤/賦形剤、着色剤、香料およびそれらに使用される原材料。
タイプV:FDAが受け入れることができる追加情報。
*注:2000年以降、FDAはタイプI DMF文書を受け付けなくなりました。
登録情報の要件
DMF登録資料はe-CTD形式で提出でき、そのうちタイプIII.のDMFは紙版とe-CTD形式で提出することができ、紙版は2022年2月に締め切られ、DMFの電子版はFDAの電子申請ゲートウェイ(ESG)を通じて提出でき、10GBを超える登録資料についてはCD-ROMなどの物理媒体を提出することができます。
登録プロセス
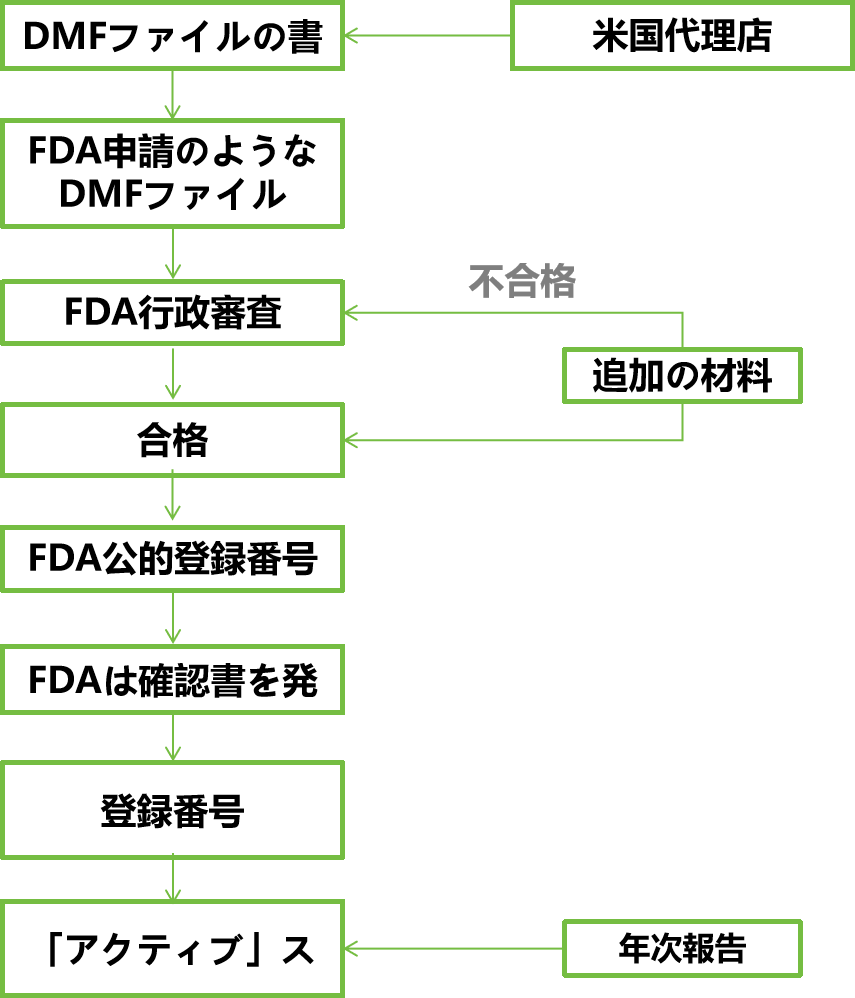
サービス内容
· 米国エージェントサービス
· 関連するFDA規制の要件に従って、DMF申請資料の概要のリストを提供します
· 登録データのギャップ分析、品種情報に基づく事前レビュー、顧客への修正提案
· CTDフォーマット登録資料の審査、翻訳、編集、提出
· FDAの審査はプロセス全体を通して追跡され、補足的な質問と回答、および補足的な回答資料が提出されます。
· DMF番号の維持、登録データの更新(変更および年次報告書を含む)。
私達の利点
· プロフェッショナル - 中国、米国、欧州における医薬品規制研究において数十年の経験を持つ複雑な規制コンサルティングチームで、専門的な技術コンサルティングサービスを保証します。
· 効率的 - このプロジェクトには専属の技術コンサルタントとビジネスコンサルタントが常駐しており、お客様のニーズにタイムリーに対応し、お客様のコンプライアンス価値の創造に専念しています
· 品質 - コンサルティングプロジェクトと標準化されたサービスプロセス管理における豊富な経験、および高品質のサービスプロセスと優れた顧客体験を保証するための中国語、英語、日本語の多言語コンサルティングサービス
· リソース - 当局者や業界の専門家との長期的な友好的なコミュニケーションチャネルを確立し、サービスの品質と効率を大幅に向上させます

