一般用医薬品とは、医師の処方箋なしで購入できる医薬品のことで、一般用医薬品とも呼ばれています。
米国では、にきび治療薬から手指消毒製品まで、米国FDA(食品医薬品局)によって規制されているOTC医薬品の80以上のクラスがあります。 現在、米国市場では30万種類以上のOTC医薬品が販売されており、OTC医薬品は米国の医療制度においてますます重要な役割を担っています。
米国でOTC商品に登録する方法
米国でOTC医薬品を登録するには、2つの方法があります。
❶ 新薬申請:未知または未認識の有効成分の安全性と有効性を指します。 これらの製品は、販売する前にFDAによる事前承認を受ける必要があります。 このルートでの申請には、その安全性と有効性を証明するために、臨床試験を含む完全な医薬品申請書類が必要です。
❷ OTCモノグラフ:有効成分の安全性と有効性(GRASE)が一般的に認められています。 モノグラフは、有効成分、ラベル表示、その他の一般的な要件を含む、このタイプの製品に関する制限を概説しています。 製品がモノグラフの要件を満たしている場合、FDAによる事前承認は必要ありません。
OTCモノグラフ医薬品の要件
一般的には、米国FDAがOTC医薬品の有効成分を統一的に審査し、最終的にOTCモノグラフを発行します。
OTCモノグラフは、活性物質標準物質に相当します。 OTC製品の場合、その有効成分がOTCモノグラフの要件を満たしている限り、FDAの承認なしで直接販売できます。
ただし、FDAの承認がないからといって、OTC医薬品を販売するためのコンプライアンス義務がないわけではなく、製品には次のような特定の要件を満たす必要があることに注意する必要があります。
· OTC医薬品の有効成分には既製のOTCモノグラフが必要であり、企業が使用する有効成分はOTCモノグラフの要件を満たしており、そうでない場合は、製品はOTC新薬を申請する必要があります。
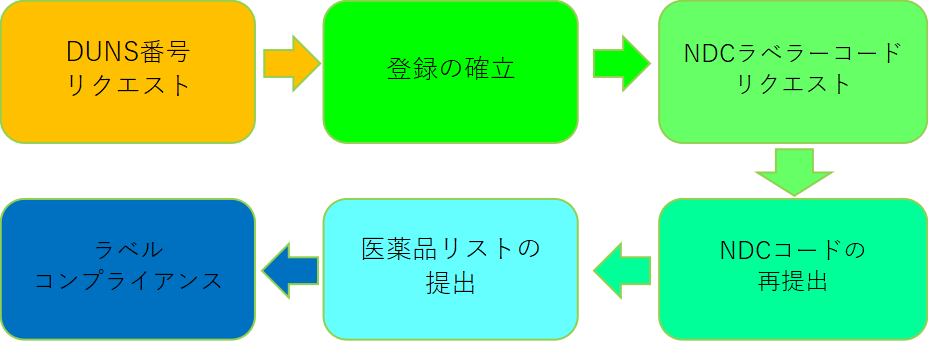
· OTC医薬品の製造業者または輸出入業者は、FDAサイトをFDAに登録する必要があり、米国外の企業の場合は、米国内の代理店を使用してFDAサイトを登録する必要があります。
· 一般用医薬品の国家医薬品コード(NDC)を申請します。
· 企業は、米国市場に参入するすべてのOTC医薬品のリストを作成し、FDAにバックアップしなければならず、その後、リストは少なくとも年に2回、6月と12月に更新されなければなりません。
· OTC医薬品のラベル表示は、適切な表示規制に準拠する必要があります。
· 製造施設は、現行の適正製造基準(cGMP)の要件を満たす必要があります。
医薬品登録プロセスに関するOTCモノグラフ
サービス内容
· DUNS番号を申請する。
· FDA医薬品製造施設登録
· OTC製剤ラベルの審査
· 製品登録
· 製品の年次更新

