規制の概要
米国食品・医薬品・化粧品法および連邦規則集第21章に基づく米国食品医薬品局(FDA)の新薬審査プロセスには、新薬臨床試験のIND申請と新薬販売申請のNDAの2つの申請があります。
治験薬(IND)では、化合物が前臨床試験に合格した後、申請者がFDAにIND申請書を提出し、化合物をヒト試験に適用できるようにする必要があります。
IND申請段階では、FDAは通常、医薬品申請者に(最低限)次のことを要求します。
1. 薬の薬理学的研究を完了します。
2. 急性毒性試験は少なくとも2匹の動物で実施されました。
3. 使用目的に応じて、2週間から3ヶ月の期間の薬物の短期試験が実施された。
新薬承認申請(NDA)。
NDA申請の資格を得るには、医薬品は次の基準を満たす必要があります。
1. 新しい分子実体(NME)
2. 新化学物質(NCE)
3. 元の承認された薬と同じ化学組成を持つ新しい塩基と新しいエステル基
4. 承認済み新薬の組成
5. 既承認薬(一般用医薬品への処方箋を含む)の新たな適応症
6. 新剤形、新投与経路、新仕様(単位内容)
7. 以前に承認された2つ以上の薬剤の新しい組み合わせ
企業の義務と対処戦略
IND/NDAの申請者は会社(法人)である必要はなく、外国人申請者は米国の代理人を通じてFDAにIND/NDA申請書を提出し、FDAと連絡を取り合って関連する登録事項を処理することができます。
登録の目標:臨床試験申請または販売申請のための承認書をFDAから取得すること。
登録と手続き
登録の種類
INDおよび/またはNDAの対象となる医薬品
登録プロセス
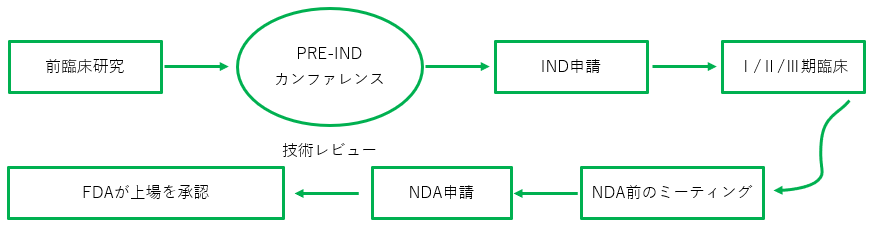
サービス内容
· 米国の規制要件に従って、米国における品種のINDおよび/またはNDA登録の実現可能性を分析します。
· 登録資料のギャップ分析、各種情報と組み合わせた事前審査、顧客への修正提案
· Pre-IND / Pre-NDA会議の準備、レビュー、翻訳、CTD形式の登録資料の作成と提出
· 医薬品登録の公式審査はプロセス全体を通じて追跡され、FDAは補足質問を発行し、補足回答資料が提出されます。
· cGMPコンプライアンスの事前監査、ソフトウェアとハードウェアのステータスのレビュー、顧客による時間通りの修正完了のガイドと支援
私達の利点
· プロフェッショナル - 中国、米国、欧州における医薬品規制研究において数十年の経験を持つ複雑な規制コンサルティングチームで、専門的な技術コンサルティングサービスを保証します。
· 効率的 - このプロジェクトには、顧客のニーズにタイムリーに対応するために専属の技術コンサルタントとビジネスコンサルタントが常駐しており、顧客のためにコンプライアンスの価値を創造することに専念しています。
· 品質 - コンサルティングプロジェクトと標準化されたサービスプロセス管理における豊富な経験、および高品質のサービスプロセスと優れた顧客体験を保証するための中国語、英語、日本語の多言語コンサルティングサービス
· リソース - 当局者や業界の専門家との長期的な友好的なコミュニケーションチャネルを確立し、サービスの品質と効率を大幅に向上させます。

