規制の概要
中華人民共和国薬品管理法、中華人民共和国薬品管理法施行条例、医薬品登録管理弁法に基づき、革新的医薬品および薬学、薬理学、毒物学、医薬品臨床試験などの関連研究業務は、販売前に完了する必要があります。 革新的新薬の申請者は、必要に応じて国家薬品監督管理局(NMPA)の医薬品評価センター(CDE)に製造販売申請を提出し、CDEに受理され、技術審査を完了した後、国家薬品監督管理局(NMPA)に転送され、承認されます。
企業の義務と対処戦略
申請者は、法律に従って、国家薬品監督管理局の医薬品評価センター(CDE)に革新的医薬品の製造/販売登録申請書を提出します。
輸入または国産の革新的医薬品の場合、国内の申請者は中華人民共和国の領土で合法的に登録された機関または個人であり、対応する法的責任を独自に負うことができ、海外の申請者は海外の合法的な医薬品製造業者であり、海外の申請者は関連する医薬品登録事項を処理するために中国の企業法人を指定するものとします。
登録目的:「輸入医薬品登録証明書」/「医薬品登録証明書」または医薬品承認番号を取得すること。 申請者が医薬品登録証明書を取得した後、申請者は製造販売承認保有者です。
登録と登録プロセス
登録の種類
輸入薬または国産の革新薬については、漢方薬、化学薬、生物製剤の分類に従って登録管理する必要があります。
登録情報の要件
漢方薬は、国家食品薬品監督管理局の「漢方薬の登録分類および申請資料の発行要件に関する通知」(No.68 [2020])の要件に準拠する必要があります。
化学医薬品は、化学医薬品の登録分類および申請資料の発行要件に関する国家食品薬品監督の通知(2020年第44号)の要件を満たす必要があります。
生物学的製剤は、生物学的製剤の登録分類および申請資料の発行要件に関する国家食品医薬品局の通知(No.43 [2020])の要件に準拠する必要があります。
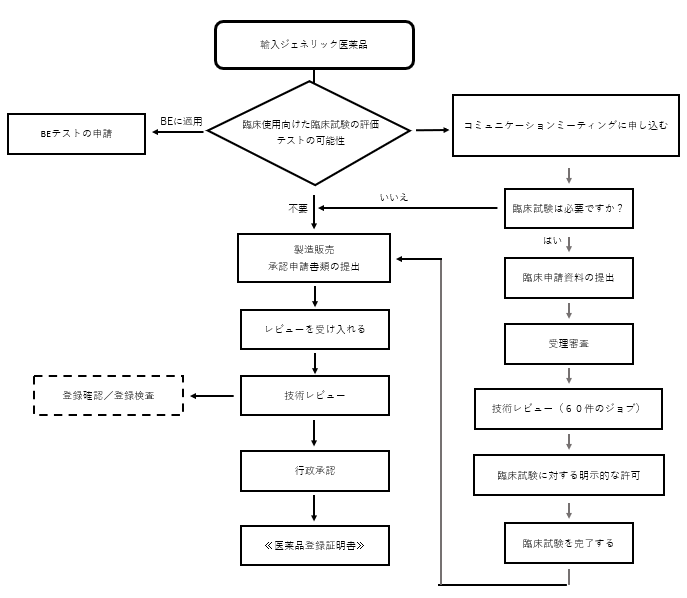
登録プロセス
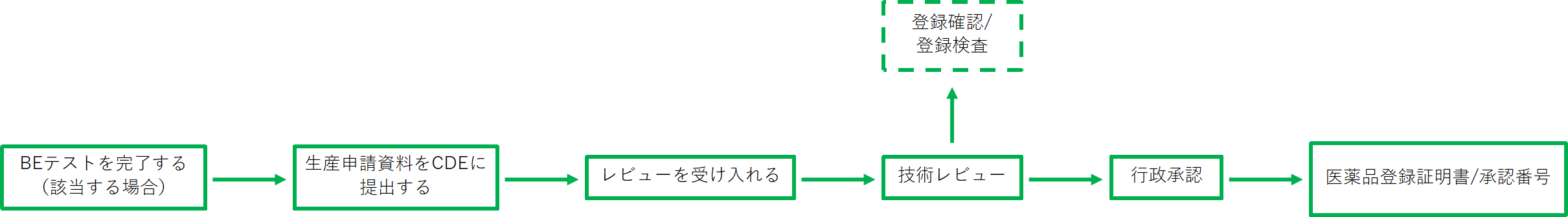
(注)技術審査により、現地検証と登録検査が必要です
サービス内容
· 中国の規制要件に従った中国における品種の医薬品登録の実現可能性の分析(迅速化販売登録手続きの適合性を含む)
· 応募書類の概要を記入してください
· 登録資料のギャップ分析、各種情報と組み合わせた事前審査、顧客への修正提案
· CTDフォーマット登録資料の審査、翻訳、編集、提出
· 検査サンプリング、要求、追跡、および問題解決の登録
· 医薬品登録の全プロセスが公式に追跡され、CDEの発行と補足質問に回答し、補足回答資料が提出されます。
REACH24Hの利点
· プロフェッショナル - 中国、米国、欧州における医薬品規制研究において数十年の経験を持つ複雑な規制コンサルティングチームで、専門的な技術コンサルティングサービスを保証します。
· 効率的 - このプロジェクトには、顧客のニーズにタイムリーに対応するために専属の技術コンサルタントとビジネスコンサルタントが常駐しており、顧客のためにコンプライアンスの価値を創造することに専念しています
· 品質 - コンサルティングプロジェクトと標準化されたサービスプロセス管理における豊富な経験、および高品質のサービスプロセスと優れた顧客体験を保証するための中国語、英語、日本語の多言語コンサルティングサービス
· リソース - 当局者や業界の専門家との長期的な友好的なコミュニケーションチャネルを確立し、サービスの品質と効率を大幅に向上させます

