化粧品新原料の申請熱が高まり続ける中、安全食用履歴がある化粧品新原料(事例5)は、企業が優先的に選択する申請ルートの一つとなっており、また、食品・健康食品など異業種からの参入企業にとっても注目される原料タイプとなっています。
REACH24Hは、関連法規およびガイドラインに基づく「安全食用履歴」の判断基準を整理し、さらに届出データを基に、現在一般的な「安全食用履歴」を有する新原料のタイプ、申請トレンド、注意点について分析を行いました。本稿が皆様のご参考になれば幸いです。
「安全食用履歴」の判断基準
中国「化粧品登録・届出管理弁法」によれば、以下のいずれかの条件を満たす原料は、「安全食用履歴」を有する新原料として扱われます:
中国の関連監督管理機関から食品安全に関する認証またはその他の相応の資格を取得した食品用原料
海内外の監督管理機関、技術機関、またはその他の権威ある機関により「安全に食用可能」と公表された原料
2025年6月25日、中国食品薬品検定研究院(NIFDC)は「化粧品新原料安全食用歴研究及び判定ガイドライン(試行)」(以下、「ガイドライン」)を公表し、安全な食用履歴に関する内容をさらに詳しく説明しました。
「ガイドライン」では、「安全食用履歴」を有する原料が以下のように具体的に分類されています:
一般食品原料
地域特有の食品原料
薬食同源原料(食品としても使用される中薬材)
新食品原料
食用に制限が設けられる可能性のある健康食品原料
| 「安全食用履歷」のある原料 | 出所 · 由来 | 関連証明資料 |
| 一般食品原料 | 榖類、果物·野菜、肉類などの一般食品 | • 中国国家食品安全基準 • 中国国家監督部門が発行した通知 · 公告 • 中国国内で一般食品原料として既に販壳されている証明資料 • 中国新食品原料審査終了目録 |
| 地域特有の食品原料 | 中国の一部の地域で30年以上にわたる伝統的に食用されてる食品 | • 省級以上の行政部門が制定した現行有効な食品安全基準(地方食品安全基準を含む) |
| 薬食同源原料 | 伝統的に食品かつ中薬材として用いられてきた物 | • 「引き続き保健食品原料の管理を規範化の通知」(衛法監発 [2002] 51号)「食品かつ医薬品の物品リスト」 • 「当帰等6種類の伝統的に食品かつ中薬材とされる物質の追加に関する公告」(2019年第8号) • 「党参等9種類の伝統的に食品かつ中薬材とされる物質の追加に関する公告」(2023年第9号) • 「地黄等4種類の伝統的に食品かつ中薬材とされる物質の追加に関する公告」 (2024年第4号) |
| 新食品原料 | 新たに食品として申請された原料 | • 国務院衛生行政部門が承認した公告なと |
| 健康食品原料 | 健康食品に用いられる原料 | • 「保健食品原料目録」 • 「保健食品において表示可能な保健機能目録」なと |
2024年5月31日に公表された「化粧品新原料安全食用歴研究及び判定ガイドライン(試行)(意見募集稿)」と比べ、当該「ガイドライン」では、意見募集稿に記載されていた食用原料を一般食品原料にも含めるとともに、健康食品原料に関する資料要求が追加され、安全食用歴史の原料の種類および資料要求をさらに明確にしています。
公表済みの新原料申請の根拠
2021年の新規公開以降、285件の化粧品新原料(同一原料名を含む)が届出・公示されており、その中で「安全食用履歴」を有すると考えられる新原料は以下の通りです。
公開資料によると、約60件の化粧品新原料が安全な食用履歴の根拠を持つ可能性があります。その中で、ピロロキノリンキノン二ナトリウム塩 (Pyrroloquinoline Quinone Disodium Salt) 、金耳(Naematelia Aurantialba)子実体抽出物、N-アセチルノイラミン酸(N-Acetylneuraminic Acid)、フコシルラクトース(Fucosyllactose)は複数の企業により何度も届出されており、注目されている原料となっています。
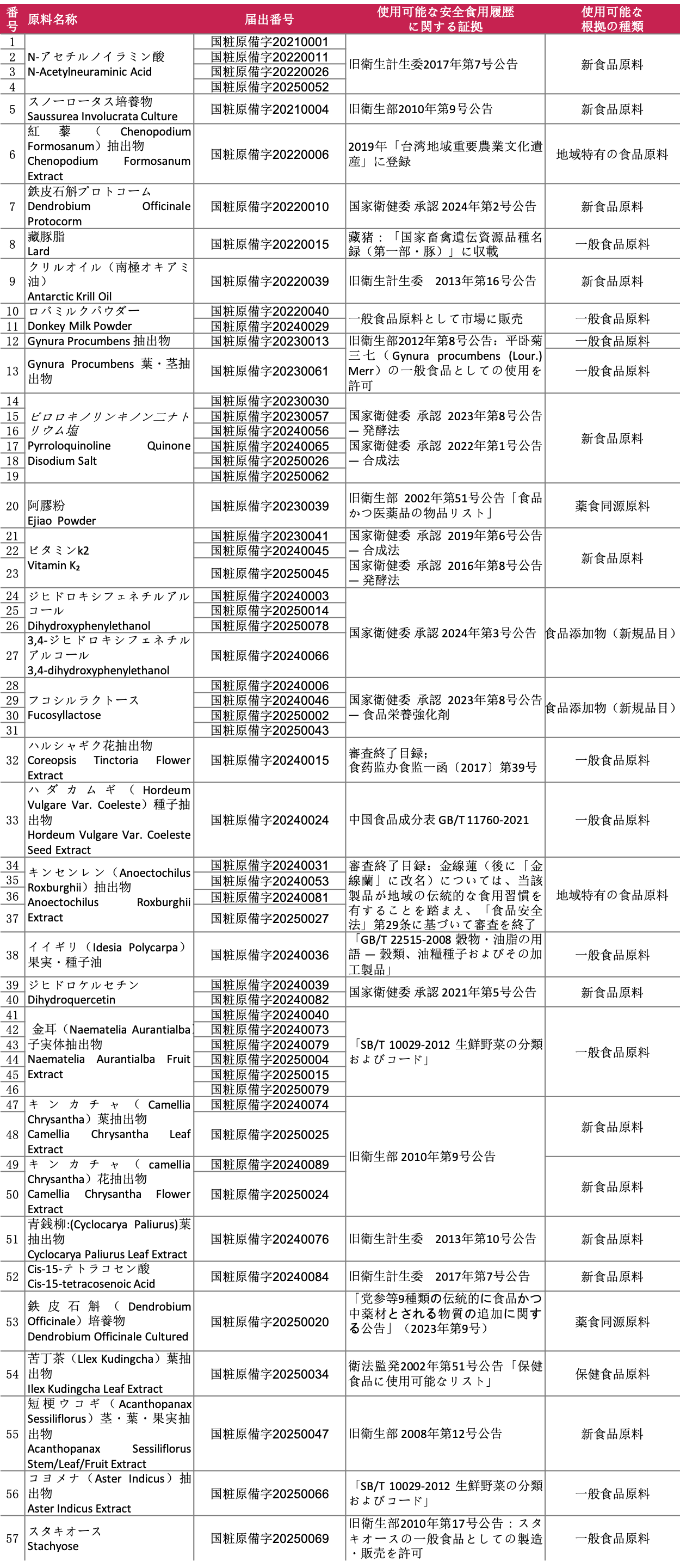
安全な食用履歴がある原料に関する根拠と判定は、化粧品新原料の申請資料作成に極めて重要です。十分な安全な食用履歴の証明資料を準備する際には、申請予定の新原料が安全な食用履歴に記載されている食品原料と一致または関連性があり、かつ安全性が確保されているかを考慮する必要があります。
また、「ガイドライン」では安全な食用履歴は主に全身毒性関連試験項目の免除に用いられることを示しています。しかし、美白・シミ取り機能を有する新原料については、化粧品原料として人体の皮膚に長期的に使用される安全リスクを排除できないため、必要な追加データや試験研究を補完する必要があるとしています。
食品原料に関するQ&A
出典:中国国家食品安全リスク評価センター(CFSA)が公表した「三新食品」と食薬物質に関するよくある質問と返答
1. 食品抽出物は食品原料として使用できますか?
食品原料は成分が複雑であり、抽出方法も多様であるため、食品抽出物の管理方法は原則としてケースバイケースで具体的に分析されます。食薬物質目録に掲載されている物質は、食品の製造・加工過程において単純な水抽出処理(物質の基本構造を変えない処理)が認められています。その水抽出液を物理的処理(冷凍乾燥、噴霧乾燥、真空乾燥、熱風乾燥など)によって濃縮液、エキスまたは粉末に加工し、これを原料として一般食品の製造に使用することが可能です。しかし、最終製品中の含有量は、原物質の伝統的な使用量に換算した値と一致している必要があります。新食品原料としての使用については、関連公告の規定に従う必要があります。関連する問題については、「中国国家衛生計画出産委員会政務公開弁公室による新食品原料、一般食品および健康食品に関する説明」を参照してください。
2. タンパク質加水分解物は食品原料として使用できますか?
旧・中国国家衛生計画出産委員会2013年第3号公告によると、食用可能な動植物由来のタンパク質を原料とし、「食品添加物使用標準(GB2760-2014)」で使用が許可されている食品用酵素製剤により加水分解して製造された物質は、一般食品として管理されると規定されています。食用動植物とは、一般食品として管理されている動植物を指します。新食品原料由来のタンパク質を、許可された食品用酵素製剤で加水分解して得られた物質の場合、その摂取不適合者は元の新食品原料と同じとし、推奨摂取量は製造企業が当該新食品原料のタンパク質含有量に基づいて換算します。不適合者や推奨摂取量は、公告の規定に従い表示される必要があります。
加水分解卵黄粉(Bonepep)(旧衛生部2008年第20号公告)、トウモロコシオリゴペプチド粉(Corn oligopeptides powder)(旧衛生部2010年第15号公告)、小麦オリゴペプチド(Wheat Oligopeptides)(旧衛生部2012年第16号公告)などは、いずれも食用動植物由来のタンパク質を原料とし、GB 2760で使用可能の食品用酵素製剤により加水分解されており、2013年第3号公告の規定に適合し、一般食品として管理可能です。
REACH24Hによる補足:
上記の質問返答は特定条件下で一部の食品抽出物およびタンパク質加水分解物が食品原料として使用可能と明示していますが、化粧品原料としての安全な食用履歴の根拠を検討する際には、原料の同一性(原料の由来、製造工程、実際の組成、使用規格など)をさらに考慮する必要があります。
3. 「三新食品」とは何ですか? 中国ではどのように管理されていますか?
「三新食品」とは、「食品安全法」第37条に記載されている「新食品原料」「食品添加剤新品種」および「食品関連製品新品種」を指します。「食品安全法」およびその施行条例、「新食品原料安全性審査管理弁法」、「食品添加物新品種管理弁法」、「食品関連製品新品種行政許可管理規定」などに基づき、中国では「三新食品」に対して行政許可制度を実施しています。すなわち、新食品原料を用いて食品を製造したり、食品添加剤新品種や食品関連製品新品種を製造する場合には、国務院の衛生行政部門に安全性評価資料を提出しなければなりません。国務院の衛生行政部門は、申請を受理した日から60日以内に審査を実施し、食品安全要件を満たしている場合は、許可を与えて公示します。不適合と判断された場合は、許可を出さず、その理由を文書で説明します。現在、「三新食品」に関する行政許可業務は中国国家衛生健康委員会が担当しており、国家食品安全リスク評価センター(CFSA)が「三新食品」の技術審査などの業務を担当しています。
REACH24Hは、企業が安全な食用履歴がある化粧品新原料を申請する際には、関連法規の要件に十分注意し、製品が円滑に適法となるよう努めることを改めて呼びかけます。

