前回の記事では、米国食品接触材規制体系について共有し、米国市場に輸出される食品接触物質が米国食品医薬品局(FDA)の規制対象である食品接触物質(FCS)かどうかを判定する必要があることを説明しました。そうでない場合、新しい食品接触物質または用途と見なされます。そして、食品接触通告申請(FCN)は新しい食品接触物質がクリアすべき重要なステップです。本記事では、FCNの要件と申請手続きについて詳しく解説します。
米国食品接触通告申請(FCN)の概要
FCNの背景
1958年、「連邦食品・医薬品・化粧品法」(FD&C)が改正され、第409条が追加されました。この条項では、新しい食品添加物はFDAの承認を得た後でなければ食品に使用できないと規定されています。この要件を満たすため、FDAは申請手続きを制定し、個人がFDAに新しい食品添加物の承認を申請できるようにしました。食品に移行することが予想されるすべての食品接触物質は承認を受ける必要があります。
1997年、「食品・医薬品近代化法」(Food and Drug Administration Modernization Act, FDAMA)によりFD&C第409条が改正され、食品接触通告手続き(FCN)が設立され、以前の申請手続きに代わるものとなりました。これにより、食品接触物質の審査が迅速化されました。
2000年1月18日、FDAは新しい食品接触通告(FCN)の申請受付を開始し、2000年7月にはFCN承認手続きに関する関連規則(草案)を発表しました。この規則は2002年5月に最終決定され、21 CFR第170.100-106条に編入されました。
FCNの特徴
GRAS物質(一般的に安全と認められる物質)および規制免除(TOR)リストはすべての製造者に適用されます。一方、FCNはこれとは異なり、FD&C第409(h)(1)(c)条に基づき、FCNは通告で認定された製造者および物質にのみ有効です。FCNで特定された製造者または供給者のみが規範に基づいてその物質を使用または販売することができます。
そのため、同じ製品であっても、ある製造者がFDAの承認を得ている場合でも、他の製造者が同じ製品を製造する場合には新たにFCNを申請する必要があります。
誰がFCNを申請できるのか?
誰でもFDAに食品接触通告を提出することができます。FD&Cでは製造者または供給者を指していますが、FDAは「供給者」という用語をより広く解釈しており、以前の食品添加物申請手続きで認可された者も含まれます。これにより、FCN手続きへの移行時に誰も排除されないようにしています。
FCN申請状況の分析
FCNの技術評価期間は120日であり、安全性に問題がなければ120日以内にFCNは自動的に発効します。その後、FDAは申請者に確認書(FDAが発行する確認書)を送付し、発効日を確認します。発効したFCNはFDAのウェブサイトで公開されます。
FCN承認手続きは効率的かつ迅速であり、同じ物質であっても製造者が異なる場合にはそれぞれがFCNを申請する必要があるため、米国で毎年承認される有効なFCNの数は中国やEUでの新物質承認数を大きく上回っています。
以下の図は、過去7年間における中国、EU、米国の食品接触物質の新規承認数を比較したものです。
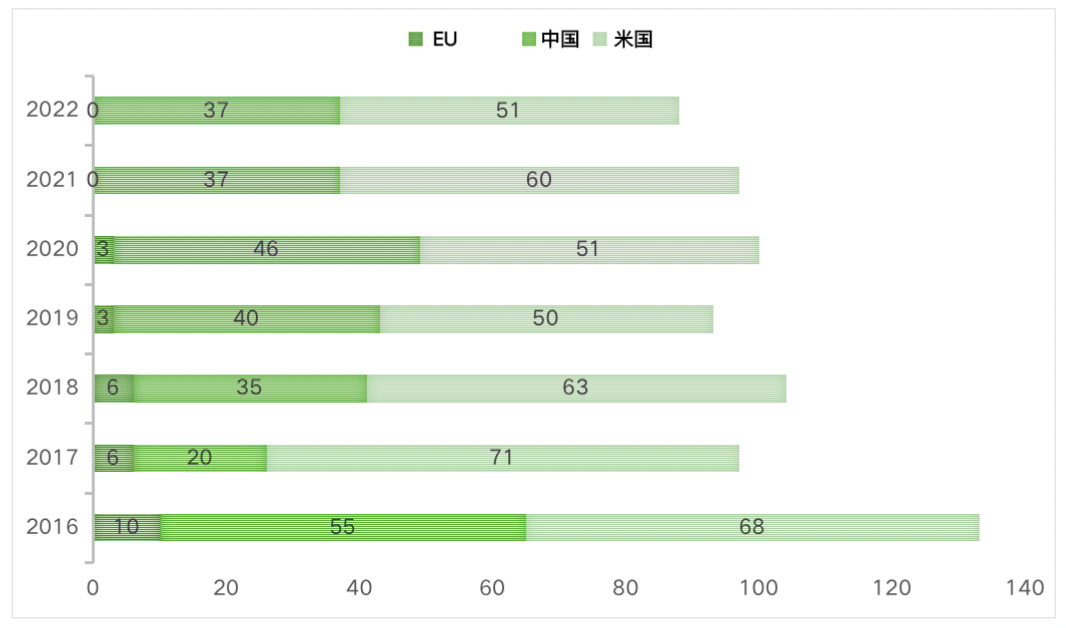 2016-2022年中国、EU、米国の新物質承認数の比較
2016-2022年中国、EU、米国の新物質承認数の比較米国食品接触通告(FCN)
申請
申請手続き
申請者が食品添加物安全局に登録書類を提出すると、FDAはFCN番号を割り当て、資料を評価チーム(FDA内の専門チーム)に送付します。評価チームはFCN受理後の最初の3週間以内に第一段階評価会議を行い、データおよび情報の完全性を審査します。
提出情報が完全である場合、申請者はFDAから確認書を受け取ります。この確認書の日付が120日間の審査期間の開始日となり、第二段階評価に進むことを示します。
「第二段階」評価期間中に問題がなければ、FCNは120日以内に自動的に発効し、消費者安全担当官が申請者に発効日を確認する書簡を送付します。
 食品接触通告申請手続きフロー図
食品接触通告申請手続きフロー図
申請資料の要件
申請物質の安全性を証明するため、FDAに食品接触通告(FCN)を提出する際には、完全なデータおよび関連情報を準備する必要があります。これには、以下のデータが含まれます:
理化学データ
移行評価
毒性学評価
環境評価
具体的なデータ要件は、FDAが発行するform3480に記載されており、以下の9つの分野に分類されています。
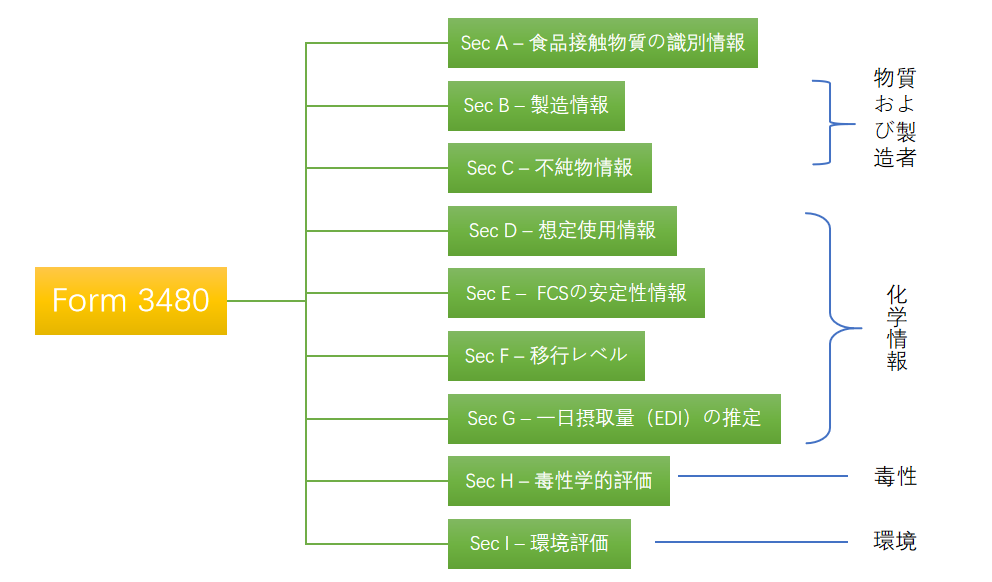 申請資料要件
申請資料要件
