エクソソームはEVsのサブグループの一つで、直径はおよそ20~200nm(ナノメートル)であり、タンパク質、脂質、多糖類、RNAなどを含み、標的細胞に作用することにより、細胞間のシグナル伝達や情報交換において重要な役割を果たします。
近年、エクソソームは、その天然の送達能力、生体適合性、および低免疫原性により、薬物送達や疾患治療の研究分野で注目を集めています。エクソソーム医薬品ががんや神経疾患などの分野で画期的な進展を遂げる中、世界的な規制コンプライアンスが医薬品企業の「海外進出」における重要なハードルとなっています。
なぜエクソソームにアメリカDMF登録が必要なのか?
アメリカのDMF登録とは、原薬、添加剤、または包装材料の製造、工程、品質に関する機密技術資料をFDAに提出することです。エクソソーム製品に関しては、DMFには主に製品情報、製造情報、特性評価、品質管理、標準品、包装材料・容器、安定性などの内容が含まれます。
DMF登録はエクソソーム企業に以下の3つのコア価値をもたらします:
コンプライアンスの必須要件:エクソソームが薬物キャリアまたは有効成分(siRNA搭載など)として使用される場合、DMFを通じてそのCMC(体制がFDA基準に適合していることを証明し、国際市場への適法な進出を保証します。
協業優位性:登録番号を下流の製剤企業(バイオ医薬品企業など)に許可することで、サプライチェーンの信頼性を高めます。
審査の迅速化:DMFの参照により、FDAによるIND/NDA/BLA資料の重複審査が削減され、製品の上市スピードが向上し、グローバル展開を加速できます。
アメリカDMFの登録方法
米国外企業に対し、FDAはアメリカ現地代理人(US Agent)を指名してDMF登録を担当することを推奨しています。具体的には以下の業務を含みます:
FDAとの公式連絡窓口として登録事務を処理します
DMF文書の提出および更新管理を担当します
FDAからの照会および審査要請に迅速に対応します
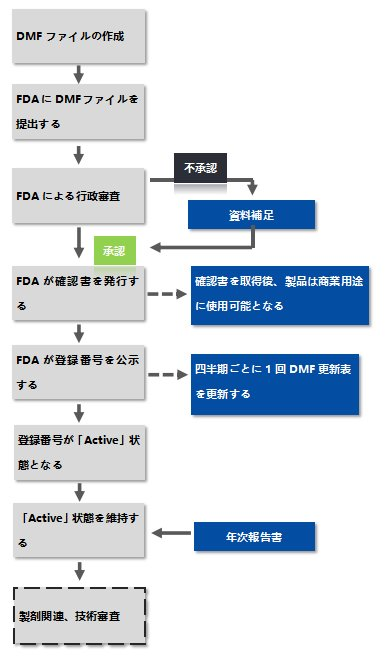
登録プロセスは以下の通りです:
アメリカDMF登録プロセス
提出すべき資料
エクソソーム製品の登録はFDA Type II DMFに該当し、提出書類は以下の通りです:
11-forms
12-cover-letters
13-administrative-information
112-other-correspondence
114-labeling
us-regional
32s1-gen-info
32s2-manuf
32s3-charac
32s4-contr-drug-sub
32s5-ref-stand
32s6-cont-closure-sys
32s7-stab
どのような重要点に注意すべきですか?
新らたなバイオ製品として、エクソソームはFDA Type II DMF登録において特別な注意点があります。以下に重点的に配慮すべき点を示します:
エクソソームの特性評価について
タンパク質および脂質の分析:エクソソームには複雑かつ低濃度のタンパク質と脂質が含まれるため、高感度な機器を用いてエクソソーム特異的タンパク質を正確に識別し、汚染タンパク質と識別する必要があります。また、脂質二重膜の構成と割合の明確も必要です。
遺伝物質の分析:エクソソームはmiRNA、mRNA、その他非コードRNAなどの遺伝物質を含む可能性があり、その種類と含量について包括的に分析し、製品の機能的一貫性と安全性を確保する必要があります。
製造工程の記述
エクソソームの由来と製造方法を正確に記載する必要があります。細胞培養由来である場合は、細胞株の選定根拠(細胞の由来、特性、安定性・品質の確保方法など)を詳細に説明します。
エクソソーム製造技術には業界標準が確立されていない部分もあるため、企業は独自にプロセスバリデーション体制を構築し、製造の安定性と管理性を確保する必要があります。
品質管理戦略
エクソソームの品質特性は複雑であり、品質管理が困難です。由来や製造方法によって品質に差が生じる可能性があるため、統一規格で完全に網羅することは困難です。
企業は自社製品の製造工程と特性に基づき、的確な品質基準とモニタリング手法を策定し、製品の安定性とロット間の一貫性を保証する必要があります。
包装材料の選定および安定性試験
エクソソームを異なる保存条件(例:-80℃、-20℃、4℃、室温)および異なる緩衝液(例:PBS、生理食塩水、特定保存液)や異なる保存容器(例:凍結保存チューブのタイプや材質)で安定性を評価する必要があります。
主要品質指標を定期的に測定し、最適な保存条件および有効期間を決定します。
注射用として使用を想定しているエクソソームについては、包装材との直接接触に関する安全性研究にも注意が必要です。
REACH24H成功事例
これまでにREACH24Hは、約100件のType II DMF登録を成功裏に完了しています。その中で、3社のクライアントに対して細胞由来エクソソームのType II DMF登録を支援し、さらに2件のエクソソーム登録プロジェクトも進行中です。
豊富なエクソソーム登録の実績とFDA審査の重点ポイントに関する深い理解により、REACH24Hはエクソソーム企業に対し、迅速かつ専門的なアメリカDMF登録サービスを提供できるほか、アメリカ現地代理人として、提出およびその後のメンテナンス業務も円滑に支援いたします。

